Autorką tekstu jest dr Ewa Krawczyk, właścicielka i autorka bloga Sporothrix
Czy słyszeliście może o zabiegu zwanym „vaginal seeding”? Jest to pobranie wydzieliny pochwowej za pomocą kawałka jałowej gazy, a następnie przeniesienie zawartości tej gazy na skórę buzi, a potem skórę całego ciała noworodka. Technika ta cieszy się pewną popularnością w gronie matek rodzących przez cesarskie cięcie. Teoretycznie sam pomysł nie jest tak zupełnie bez sensu. No chyba że wpisuje się w ogólny trend zawstydzania kobiet, które z różnych powodów nie rodziły drogą naturalną. Nie wiem bowiem, czy wiecie, ale w pewnych kręgach kobietom takim odbiera się prawo nazywania matkami - bo matka to ta, co urodziła, one były tylko w ciąży – a obchodzenie urodzin w rodzinach dzieci urodzonych przez cesarskie cięcie wyśmiewa się, określając je mianem „wydobycin” (bo dziecko nie urodziło się, tylko zostało wydobyte z macicy). Wszystko dlatego, że najwyraźniej dzieci urodzone przez cesarskie cięcie nie dorównują tym urodzonym naturalnie. Co oznacza, że każda technika, która w jakiś sposób pomoże zbliżyć je do ideału, jest mile widziana.
Mikrobiom a narodziny
I, jak pisałam, w założeniach nie jest to do końca aż tak bezsensowne. Wiadomo, że dzieci urodzone przez cesarskie cięcie mają nieco inny mikrobiom, niż te, które rodzą się siłami natury. Skład mikrobiomu tych pierwszych przypomina mikrobiom skóry matki, tych drugich – mikrobiom jej pochwy. Coraz więcej pojawia się badań sugerujących, że od składu mikrobiomu zależeć może podatność na niektóre choroby czy zaburzenia metaboliczne w przyszłości. Teoretycznie więc odtworzenie mikrobiomu matczynej pochwy u dziecka mogłoby zmniejszyć ryzyko wystąpienia tychże chorób. Taką tezę przedstawili już jakiś czas temu niektórzy badacze, podchwyciła ją prasa popularna, co spowodowało, że vaginal seeding – procedura nieskomplikowana, łatwa do wykonania bez asysty lekarza czy pielęgniarki – zyskała na popularności.
Wszystko jednak – jak zwykle – nie jest tak proste, jak mogłoby początkowo wyglądać. Są dyskusje i spory między specjalistami o to, kiedy różnica w składzie mikrobiomu noworodków urodzonych różną drogą jest widoczna, przez jak długo, i jak się to może zmieniać. Wiadomo też, że kolonizacja organizmu dziecka zachodzi jeszcze przed porodem, zatem sam poród nie musi mieć tu kluczowego znaczenia. Nie ma także pewności, że chorobom, których zwiększone ryzyko występuje po cesarskim cięciu, można, choćby w najmniejszym stopniu, zapobiec przez potraktowanie noworodka wydzielinami pochwy matki. W przypadku tych chorób najprawdopodobniej większe znaczenie mają inne współistniejące czynniki, częstsze u kobiet rodzących przez cesarskie cięcie, jak otyłość, przyjmowanie różnych leków, w tym antybiotyków, wiek rodzącej czy sposób karmienia noworodka. Zgromadzone do tej pory przez ekspertów dane nie przekonują, że to akurat mikrobiom pochwy matki ma super znaczenie oraz że, co za tym idzie, suplementacja tego mikrobiomu wpłynie jakoś korzystnie na zdrowie dziecka.
Niebezpieczne?
Nie należy także pomijać kwestii potencjalnego niebezpieczeństwa praktyki vaginal seeding. W literaturze naukowej istnieją doniesienia, jak to lekarze odwodzili od procedury matkę zakażoną opryszczką genitalną. A nie tylko z opryszczką możemy mieć tu do czynienia. Warto uzmysłowić sobie, że matka może być nosicielką patogenów, które, choć u niej samej nie muszą w danej chwili powodować aktywnego zakażenia, to jednak stanowią poważne zagrożenie zdrowia i życia jej dziecka. Chlamydia trachomatis, Neisseria gonorrhoeae, wirusy brodawczaka, wirus cytomegalii czy Escherichia coli są serio niebezpieczne, a nie we wszystkich krajach rutynowo bada się ciężarne pod kątem nosicielstwa tych drobnoustrojów.
Nie zapominajmy też o Streptococcus agalactiae, czyli o paciorkowcu grupy B (GBS, group B streptococci), który jest tematem tej notki.
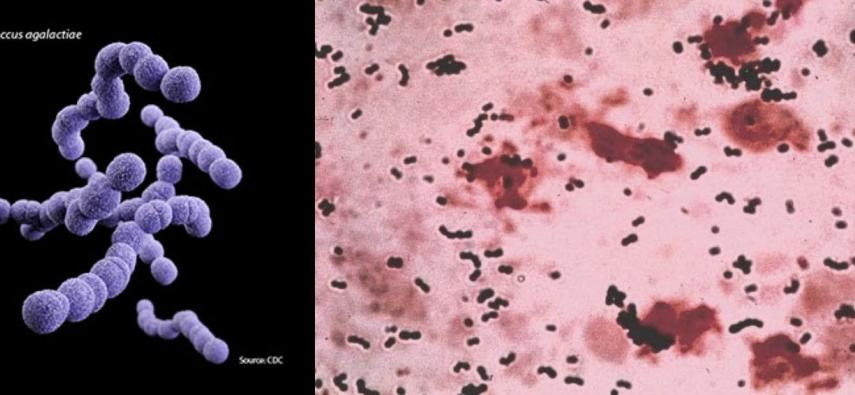
Ryc. 1. Streptococcus agalactiae – wygląd komórek oraz barwienie metodą Grama. Zdjęcia pochodzą ze strony CDC
Streptococcus agalactiae
Streptococcus agalactiae, jak nazwa rodzajowa wskazuje, należy do paciorkowców. Jest bakterią o komórkach kulistych, barwiących się Gram-dodatnio, nieruchliwą, względnie beztlenową. Na podstawie różnic w reakcji immunologicznej na cukry znajdujące się w otoczce bakteryjnej, gatunek ten podzielony jest na 10 serotypów (I, Ia, II-IX; jest to o tyle istotne, że różne serotypy mają związek z różną chorobotwórczością); stąd też możemy określać S. agalactiae jako paciorkowce (w liczbie mnogiej) grupy B, nie jest jednak żadnym błędem stosowanie liczby pojedynczej (jeden gatunek w grupie). A skąd w ogóle wzięła się nazwa grupy? Klasyfikacji ze względu na obecność polisacharydu C (od słowa carbohydrate) w ścianie komórkowej paciorkowców dokonała Rebecca Lancefield w latach 30. zeszłego wieku, i jest to klasyfikacja stosowana do tej pory, obok paru innych. (A Rebecca Lancefield, oprócz tego, że podobnie jak Kopernik była kobietą, to w dodatku była wybitnie dociekliwą naukowczynią – jej laboratorium zyskało miano paciorkowcowego Scotland Yardu. Nie wspominając już o jej rewelacyjnym przepisie na egg nog, opublikowanym zresztą w Science Friday.)
S. agalactiae, paciorkowiec grupy B wg Lancefield, posiada i wytwarza sporo czynników zjadliwości, m.in. adhezyny, fimbrie (które razem z otoczką są kluczowymi czynnikami odpowiadającymi za tworzenie biofilmu), a także różne enzymy, w tym hemolizynę. Która to hemolizyna jest podstawą do kolejnego podziału bakterii z rodzaju Streptococcus. Paciorkowce bowiem, podobnie jak niektóre inne bakterie, mogą powodować trzy rodzaje hemolizy podczas wzrostu na podłożach bakteriologicznych zawierających krew. Obserwować można wówczas: hemolizę beta, czyli całkowitą, kiedy to dochodzi do zupełnego rozkładu czerwonych krwinek w otaczającym bakteryjne kolonie podłożu, jak i pod koloniami – podłoże staje się wówczas przezroczyste; hemolizę alfa, czyli niecałkowią – bakteryjny nadtlenek wodoru utlenia hemoglobinę, powstaje methemoglobina, która zabarwia podłoże na zielonkawy kolor; oraz hemolizę gamma – czyli brak hemolizy. Paciorkowce grupy B charakteryzują się wywoływaniem słabej hemolizy beta.
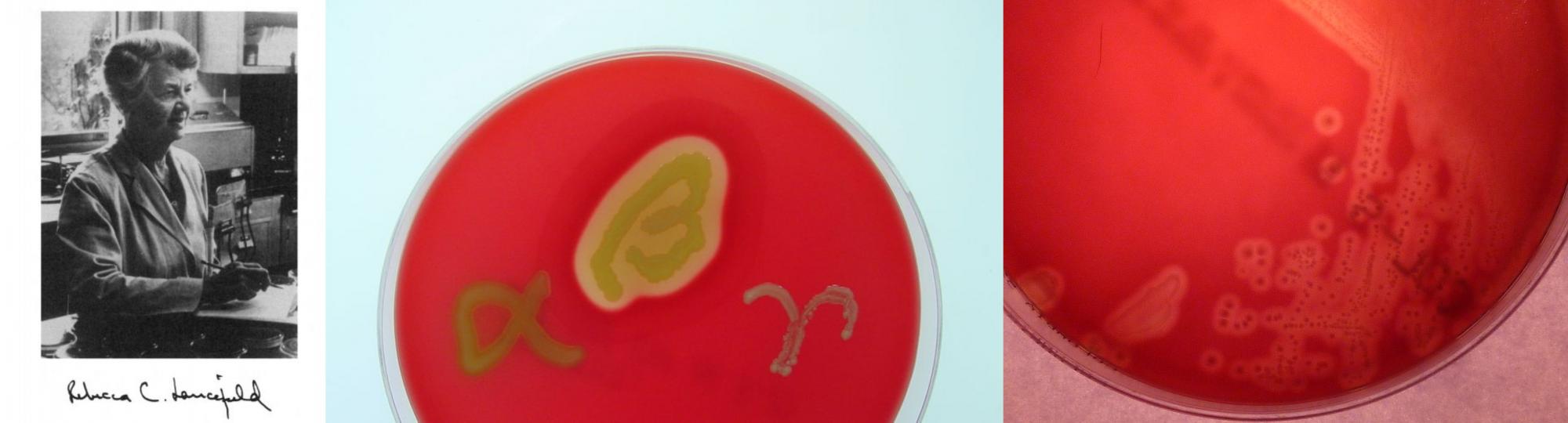
Ryc. 2. Od lewej: Rebecca Lancefield (stąd); typy hemolizy (stąd); hemoliza S. agalactiae na agarze z krwią (stąd)
S. agalactiae opisany został po raz pierwszy pod koniec XIX wieku. Przez lata uważany był za patogen powodujący zakażenia u zwierząt, szczególnie zapalenie wymienia u krów (stąd zresztą nazwa gatunkowa agalactiae, co oznacza „brak mleka”). Obecnie wiadomo, że jest to istotny klinicznie patogen człowieka. Zakażenia i/lub nosicielstwo występują w różnym zakresie w dwu osobnych grupach pacjentów: u ciężarnych kobiet i noworodków/niemowląt oraz u całej reszty populacji (choć nieco bardziej precyzyjne określenie mówi o „dorosłych nieciężarnych”).
Zakażenia spowodowane przez paciorkowce grupy B w tej drugiej grupie dotyczą przede wszystkim osób starszych oraz pacjentów z immunosupresją i/lub innymi współwystępujacymi schorzeniami. Czynnikami sprzyjającymi infekcji są cukrzyca, alkoholizm, zapalenie mięśnia sercowego czy nowotwory. Zakażenia u takich osób mogą mieć różną postać – są to zakażenia inwazyjne, bakteriemia, zakażenia skóry i tkanek miękkich, infekcje układu moczowego, a także zapalenie opon mózgowo-rdzeniowych. Zapalenie opon mózgowo-rdzeniowych o tej etiologii nie jest schorzeniem często występującym w tej grupie pacjentów, ale ma przebieg ciężki i obarczone być może dużą śmiertelnością (zależnie od serotypu, np. śmiertelność wynikająca z zapalenia opon spowodowanego serotypem V może dochodzić do ponad 70%, natomiast innymi – wynosi średnio ponad 10%). Po przebyciu zapalenia opon mózgowo-rdzeniowych spowodowanego przez S. agalactiae zdarzają się również poważne powikłania, np. zapalenie wnętrza gałki ocznej prowadzące do częściowej lub całkowitej utraty wzroku.
Zakażenia u niemowląt
Najpoważniejszy jednak problem stanowią zakażenia S. agalactiae u noworodków i niemowląt. Zakażenia te dzielimy, ze względu na czas wystąpienia, na wczesne (early-onset disease, EOD) i późne (late-onset disease, LOD).
Zakażenia wczesne silnie wiążą się z kolonizacją drobnoustrojem u kobiet. Około 30% ciężarnych jest nosicielkami S. agalactiae w pochwie, jak również w układzie pokarmowym. Nosicielstwo jest często trudne do wykrycia, nie daje bowiem objawów klinicznych, może także zanikać i pojawiać się periodycznie. Nosicielstwo w pochwie jest głównym czynnikiem ryzyka zakażenia noworodka (innymi są np. młody wiek ciężarnej, czy wcześniactwo), a przeniesienie paciorkowców od matki do dziecka zachodzi albo jeszcze w macicy, albo w momencie przechodzenia dziecka przez kanał rodny, na skutek zachłyśnięcia wodami płodowymi i wydzieliną pochwową przez dziecko. Drobnoustroje wędrują następnie do płuc noworodka, a ponieważ zwłaszcza wcześniaki nie mają dobrze wykształconych systemów obronnych w płucach, nie są tam niszczone, lecz swobodnie mogą rozprzestrzeniać się drogą krwi do innych narządów. Kolonizacja drobnoustrojem ma miejsce u 50-70% dzieci urodzonych przez matki-nosicielki. Objawy choroby EOD pojawiają się od 24 godzin do 7 dni po porodzie u 1-2% tych dzieci, a są to: zapalenie płuc (15% noworodków), bakteriemia i posocznica (80%), a także zapalenie opon mózgowo-rdzeniowych (10%). Jeszcze w latach 70. XX wieku EOD często kończyła się śmiercią (w USA śmiertelność wynosiła około 50%). Obecnie, dzięki stosowanej śródporodowo terapii antybiotykowej, i samo występowanie EOD, i śmiertelność spadła drastycznie (do 4%). Serotypami Streptococcus agalactiae odpowiedzialnymi za EOD są: Ia, II, III i V.
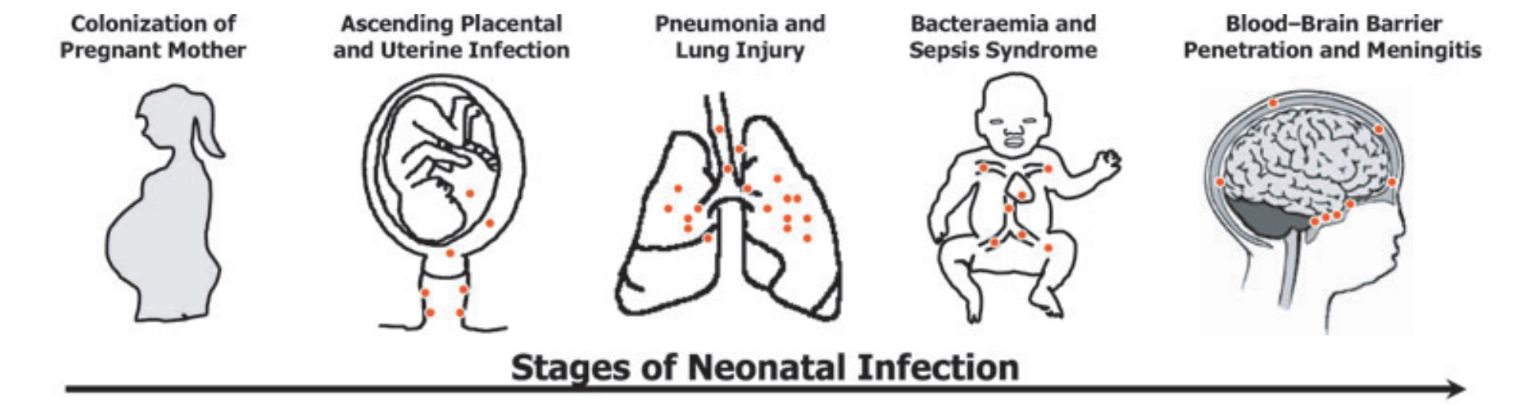
Ryc. 3. Przebieg early-onset disease przy zakażeniu S. agalactiae (rycina pochodzi z publikacji nr 7)
Ale paciorkowce grupy B odpowiedzialne także są za później występujące zakażenie u małych dzieci. Late-onset disease (LOD), wywoływana głównie przez serotyp III, pojawia się między 7 a 90 dniem po urodzeniu. Droga zakażenia nie jest tak ładnie zdefiniowana, jak w przypadku EOD, ale przypuszcza się, że dochodzi doń przez kontakt ze środowiskiem szpitalnym i domownikami, którzy są źródłem patogenów. Sugerowane jest także przeniesienie drobnoustrojów przez mleko matki - żeby było ciekawiej, możliwe, że to sam nosiciel -noworodek/niemowlę jest źródłem bakterii, którymi zakaża matkę poprzez picie jej mleka, co następnie prowadzi do zwrotnej infekcji u dziecka. Objawami LOD są przede wszystkim: zapalenie opon mózgowo-rdzeniowych (nawet 50% przypadków), a także zapalenie płuc. Śmiertelność LOD szacuje się na około 5%. Śródporodowa antybiotykoterapia nie ma znaczenia w przypadku tej postaci/fazy choroby.
Mimo częściowo skutecznych metod radzenia sobie z bakterią Streptococcus agalactiae uważany jest nadal za jeden z ważniejszych czynników bakteryjnego zapalenia opon mózgowo-rdzeniowych u ludzi. Nie dość, że powoduje zapalenie takie bezpośrednio, np. u maleńkich dzieci w trakcie EOD czy zwłaszcza LOD. Istotny jest także duży odsetek następstw takich zakażeń w wieku późniejszym. Około 20% osób, które w dzieciństwie przebyły taką infekcję, ma jakieś zaburzenia rozwojowe w obrębie układu nerwowego. U pacjentów notowano: nieprawidłowości w funkcjonowaniu układu krwionośnego mózgu, zapalenie rdzenia, nieprawidłowe wykształcenie istoty białej mózgu, zwiększoną przepuszczalność bariery krew-mózg, encefalopatie. W wieku późniejszym czynniki te wiązały się z neurologicznymi zaburzeniami rozwojowymi, w tym na tle ruchowym, z trudnościami językowymi, czy problemami kognitywnymi.
Czy warto więc ryzykować te nieszczęsne vaginal seedings?
Literatura:
|
|
|
|
|
|